|
|
Всеукраинская студенческая олимпиада,
Харьков, 2000 год, решения и комментарии |

|
1. «Алкалоїд»
1) Під назвою “алкалоїди” об'єднують нітрогеновмісні речовини різної хімічної природи рослинного чи тваринного походження, які мають основний характер і не є продуктами гідролітичного розщеплення білків.
2) З умови задачі випливає, що Х у водному розчині повністю дисоціює, утворюючи гідроксил-іони і катіони Y: X =
Y+ + OH-.
Оскільки Х – нітрогеновмісна основа, сильний електроліт, який синтезують з триметиламіну в одну стадію, справедливо припустити, що Х – четвертинна амонієва основа, яка містить угрупування
(H3C)3N+–R.
У методі кріоскопії DT = K*сm, де сm – сумарна моляльність розчинених частинок. За даними кріоскопії, сm = 0,02 моль / 1000 г води. Згідно з даними вимірювання рН, у цьому розчині pOH = 14 - pH = 12, рівноважна концентрація
[OH-] = 0,01 моль/л і практично збігається з сm(ОН-) = 0,01 моль/кг. Тоді маса катіону m(Y+) = 1,21 г – 1 л
*0.01 моль/л*17 г/моль = 1,04 г, сm(Y+) = 0,01 моль/кг, молярна маса
Y+ m(Y+) = 104 г/моль, молярна маса Х m(Х) = m(Y+) + m(ОН-) = 121 г/моль.
Позначимо склад алкалоїду СсHhNnOz. При прожарюванні Х з СuO відбувається повне окиснення алкалоїду з утворенням газуватих продуктів:
2 СсHhNnOz + (2c+h-2z) CuO = h
H2O + 2c CO2 + n N2 + Cu.
V0 = V(H2O) + V(CO2) + V(N2),
V1 = V(CO2) + V(N2),
V2 = V(N2).
Використовуючи співвідношення (Va/Ta) = (Vb/Tb), приводимо об'єми до однакової температури і знаходимо, що за цих умов
V0 : V1 : V2 = 26,00 : 11,00 : 1, звідки
V(CO2) : V(N2) = 10 : 1, V(H2O) : V(N2) = 15,
в молекулі алкалоїду кількості речовини елементів співвідносяться як
C : H : N = 5 : 15 : 1, найпростіша формула Х – C5H15NOz, молярна маса, що відповідає цій формулі, m = (60 + 15 + 14 + 16*z) г/моль = (89 + 16*z) г/моль. З іншого боку, молярна маса m(Х) = 121 г/моль, звідки z = 2, найпростіша формула збігається з істинною. Таким чином, емпірична формула Х –
C5H15NO2. Оскільки Х містить угрупування
(H3C)3N+– і гідроксил-іон, що сумарно складає
C3H10NO, на радикал R залишається С2Н5О. Зважаючи на те, що Х – аліфатичний алкалоїд, радикалом R не може бути оксіетильне угруповання –ОС2Н5, і можливі два варіанта:
1) R = HO–CH2–CH2–,
2) R = H3C–CH(OH)–CH2–.
Останній варіант треба відкинути з тієї причини, що це угруповання містить асиметричний атом карбону, а сполука Х не є оптично активною. Таким чином, формула Х має вигляд: HO–CH2–CH2–N+(CH3)3 ОН-. Це – холін.
3) Холін є лугом і з оцтовою кислотою вступає в реакцію нейтралізації. Оскільки кислота у надлишку, після взаємодії у 110 мл розчину містяться ацетат-іони у концентрації 0,0045 моль/л та оцтова кислота у концентрації 0,0036 моль/л,
рН = рКа + lg {[Ac-]/[HAc]} = 4,76 + lg 1,25 = 4,86.
N(CH3)3 + окис етилену + Н2О = холін.
2. «Море»
1) 1.5 Н2О + Н+ + KAl3Si3O10(OH)2(ос.) = 1.5
Al2Si2O5(OH)4(ос.) + К+ b
b = [K+] / [H+] = const.
(1)
С учетом условия электронейтральности водной фазы
[K+] + [H+] = [Cl-] + [OH-] = [K+] + [H+] =
[Cl-] + KW / [H+]
(2)
Из системы уравнений (1), (2) следует, что при заданной концентрации хлорид-ионов и постоянной температуре (b, KW постоянны) равновесные концентрации [K+] и [H+] определены однозначно! Следовательно, пока добавки КОН не приведут к полному растворению одной из фаз, рН сохранится постоянным. Силлен говорил: «ocean is a pH stat rather than a buffer». Добавки HCl на уровне концентрации К+ мало скажутся на величине рН, т.к. в данном случае система ведет себя как гетерогенный буфер.
2) Легко видеть, что для растворения FeOOH без изменения степени оксиления железа наиболее важна реакция
FeOOH(ос.) + H+ = Fe(OH)2+ + H2O
lg K = -2.35
Тогда при рН 8.1 [Fe(OH)2+] = 10-10.45 моль/л. Концентрации
FeOH2+ Fe2(OH)24+ – порядка 10-15 и 10-27 м/л.
Можно допустить, что происходит растворение FeOOH с одновременным восстановлением Fe(III) до Fe(II):
FeOOH(ос.) + 3H+ = Fe3+ + 2 H2O
lg K = 3.96
+
Fe3+ + e- = Fe2+
lg K = 13.0
___________________________________________________
FeOOH(ос.) + 3H+ + e- = Fe2+ + 2 H2O
lg K = 16.96 примерно 17
Отсюда lg [Fe2+] = 17 - 3pH - pE = -7.3 - рЕ.
Чтобы рассчитать рЕ, обратимся к полуреакции
O2 + 2 H2O + 4 e- = 4 OH- E0 = 0.40 B
E = 0.40 + (0.059/4) lg {p(O2) / [OH-]4} = 0.40 + 0.01475 lg
{0.21/(10(8.1-14)*4} =
= 0.40 + 0.34 = 0.74 B,
pE = 0.74 / 0.059 = 12.51 примерно равно 12.5
Тогда lg [Fe2+] = -7.3 - 12.5 = -19.8,
суммарная концентрация растворимых форм железа <1010 моль/л,
т.е. в 1000 раз меньше экспериментально определеяемой. Или океан не равновесен, или есть дополнительные факторы переноса железа в раствор (комплексообразование с фосфат-ионами, органическими лигандами и т.п.), или при определении концентрации растворимого железа неправильно «засчитали» содержание коллоидных частиц Fe(OH)3.
3. «Чемпіонат з титрування»
1. Ниф-Ниф оттитрует фосфорную кислоту как одноосновную и израсходует 6,4 мл титранта, Наф-Наф — как двухосновную и израсходует 12,8 мл титранта.
В дальнейшем решении используются данные о равновесном составе титруемого раствора, полученные с помощью концентрационно-логарифмической диаграммы.
Сокращения и обозначения: ТС – точка стехиометричности, КТТ – конечная точка титрования, d – относительная погрешность определения концентрации кислоты.
2. В титровании Ниф-Нифа КТТ наблюдается при рН
приблизительно 3,8 (середина интервала перехода окраски метилоранжа; КТТ1 на диаграмме). рН в ТС находим из условия:
[H+] + [H3PO4] =
[HPO42-],
выражая равновесные концентрации частиц через концентрацию продукта титрования [H2PO4-]
приблизительно равно
(0,008*20/(20+6,4))=6,1*10-3 моль/л. Отсюда рНТС = 4,84. Различие рН в КТТ и ТС превышает погрешность визуального определения рН. Раствор недотитрован, lg d = lg [H3PO4] – lg c
приблизительно равно -1,2, отсюда относительная систематическая погрешность d
приблизительно равна 6%.
В титровании Наф-Нафа КТТ наблюдается при рН
приблизительно равно 9,7 (КТТ2 на диаграмме). рН в ТС находим из условия:
[ОH-] + [PO43-] = [H2PO4-],
выражая равновесные концентрации частиц через концентрацию продукта титрования
[HPO42-] приблизительно равно
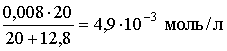 .
.
Отсюда рНТС = 9,40, что в пределах случайной погрешности визуального определения совпадает с
рНКТТ. Случайную погрешность определения концентрации найдем по формуле распространения погрешностей:
погрешность концентрации = |
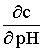 | * погрешность рН,
(1)
| * погрешность рН,
(1)
где –буферная емкость. Значение lg вблизи ТС2 можно найти по диаграмме, отсюда относительная случайная погрешность d
приблизительно равно 1,6%.
Таким образом, Наф-Наф удачнее выбрал индикатор, и имеет шанс получить более правильный (и более точный результат).
3) После добавления 10 мл титранта образуется буферная система с соотношением концентраций
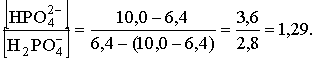
Отсюда рН = 7,199 + lg 1,29 = 7,31.
При титровании кислоты до гидрофосфата рНТС = 9,40 (см. п.2). Если закончить титрование при этом значении рН, систематическая погрешность отсутствует, но остается случайная составляющая погрешности, которую можно найти по уравнению (1). Поскольку при потенциометрическом определении рН случайная погрешность в 25 раз меньше, чем при визуальном, Нуф-Нуф получил результат с относительной случайной погрешностью d
приблизительно равно 1,6/25% приблизительно
равно 0,06 %.
4) Фосфорную кислоту можно оттитровать как трехосновную, связывая ионы
PO43- ионами кальция. Следовательно, к раствору
H3PO4 нужно добавить CaCl2, и выделившиеся ионы Н+ титровать раствором щелочи в присутствии индикатора фенолфталеина.
4. «Смуги та сигнали...»
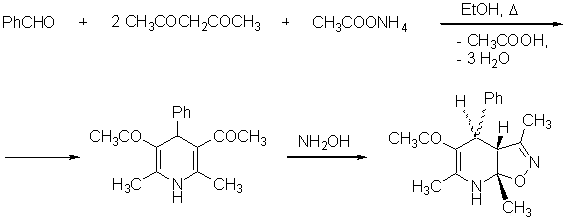
5. «Фугітивність»
Фугитивность (летучесть) используется для описания свойств реальных газов, введена Льюисом, функция температуры, давления и состава газа. Подставляется в уравнение, выведенное для идеального газа, вместо давления. Для реального газа выражение изобарно-изотермического потенциала принимает вид G = G(T) + RT ln f. Летучесть – исправленное давление; f при больших давлениях и низких температурах сильно отличается от давления.
Отношение g = Р / f называется коэфициентом активности и характеризует степень отклонения реального газа от идеальности. Приближенно летучесть определяется по уравнени. f = P2 / Pид . Из условия следует, что Рид = RT / V = 0,082*423 / 0,7696,
f = 402*0,7696 / (0,082*423) = 35, 5 (атм).
6. «Шалена швидкість»
а) Это характерная кривая зависимости скорости от времени для реакций, порядок которых выше 1.
б) Автокаталитическая реакция, в которой при накоплении достаточного количества продукта изменяется механизм: продукт при накоплении входит в кинетическое уравнение.
в) Такой вид кривой характерен для автокаталитических реакций. Пример: взаимодействие
H2S с SO2 в газовой фазе, катализируемая парами воды.
8. «Зустріч з Гіллеспі та Бете»
а) Валентный угол уменьшается: тетраэдрический (109.50), 1070, 1040. Согласно теории Гиллеспи, неподеленная пара электронов занмает больший объем. б) Валентный угол растет: 940, 970, 1000. Это можно объяснить как ростом взаимного отталкивания лигандов, так и увеличением вклада резонансной структуры с двойной связью X=P. Такая структура осуществляется за счет неподеленной пары электронов одного из атомов и вакантной d-орбитали другого; этот эффект стремится уплощить молекулу. в) Валентный угол уменьшается за счет увеличения числа лигандов. В пренебрежении эффектом Яна-Теллера для октаэдрических комплексов значения валентных углов при центральном атоме составляют 1800, 109.50, 900, 900.
1) Поскольку отрицательный конец диполя в молекуле
PH3 представлен неподеленной парой электронов атома фосфора, вектор дипольного момента при переходе от
PH3 к PF3 изменяет направление и увеличивается по абсолютной величине, а при переходе от
PF3 к PCl3 уменьшается (в Дебаях): 0.58, 1.03, 0.78. Это объясняется следующим изменением полярности связей (стрелка указывает направление смещения электронной пары): P-->F >> P-->Cl >> P<--H. Энергия связи в приведенном ряду изменяется также немонотонно:
PH3 << PF3 > PCl3. В молекуле
PH3 практически невозможна реализация резонансных структур с двойной связью, а в ряду двух других молекулах связь ослабляется из-за увеличения главного квантового числа атомных орбиталей, с участием которых она образована (или, что то же, за счет увеличения ее длины).
2,3) sp; sp3 (по крайней мере в твердой фазе, когда внутренняя сфера комплекса не содержит еще двух молекул воды);
d2sp3; sp3d2. Согласно теории кристаллического поля, лиганд
NH3 находится в середине спектрохимического ряда, поэтому в комплексе с Co3+ он будет лигандом сильного поля, а в комплексе с
Co2+ — слабого. Поэтому первый из комплексов кобальта является низкоспиновым и внутриорбитальным, а второй — высокоспиновым и внешнеорбитальным. Катион
Co3+ имеет шесть d-электронов, все они в комплексной частице спарены; катион
Co2+ имеет семь d-электронов, из них в комплексе три не спарены. Значит, первый комплекс диамагнитен, а второй — парамагнитен (магнитный момент 5.04 м.Б., тогда как оценка теории кристаллического поля дает заниженное значение
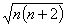 =3.87 м.Б.).
=3.87 м.Б.).
|